据6月2日消息,礼来公司(Eli Lilly)与Incyte公司宣布,其新药Olumiant(baricitinib)获FDA批准上市,治疗罹患中度至重度类风湿关节炎且TNF抑制剂对其无明显效果的成人患者。
类风湿关节炎(RA)是一种病因未明的慢性、以炎性滑膜炎为主的系统性疾病。其特征是手、足小关节的多关节、对称性、侵袭性关节炎症,经常伴有关节外器官受累及血清类风湿因子阳性,可以导致关节畸形及功能丧失。目前普遍采用的疗法是TNF抑制剂治疗,但超过65%的患者在首次治疗中得到的缓解不明显。因此,一种创新性治疗方法亟待出现。
在这种背景下,礼来与Incyte带来的Olumiant为类风湿性关节炎患者带来了新的希望。Olumiant是口服JAK抑制剂,每日一次,能高效抑制JAK1、JAK2、以及TYK2。在人体内,不少细胞因子依赖于JAK的活性,其在不少炎性疾病和自身免疫疾病的发病过程中有潜在作用。Olumiant就是通过抑制多种JAK的活性给类风湿关节炎成人患者带去新的治疗选择。
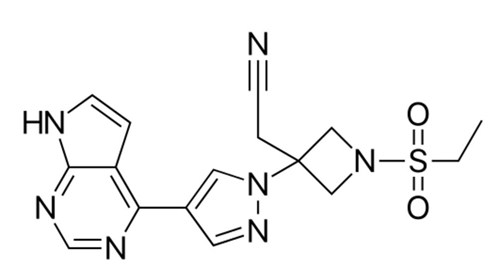
▲Baricitinib分子式
在一项名为RA-BEACON的随机、双盲、安慰剂对照的临床试验中,研究人员对Olumiant的治疗潜力进行了评估。他们招募了527名使用TNF抑制剂没有明显效果的患者。然后将患者分成三组,在常规的抗风湿药物(DMARD)外,他们分别接受2 mg Olumiant、4 mg Olumiant、或是安慰剂。
试验结果表明,在治疗的第12周,与对照组相比,接受Olumiant治疗的患者在ACR20(症状改善20%)评分上有显著提升(实验组为49%,对照组为27%)。此外,Olumiant也为患者带来了早期受益,有些患者在第一周就出现了ACR20的改善。在身体机能上,接受Olumiant治疗的患者也得到了提高。根据HAQ-DI(健康评估问卷残疾指数)的评分,实验组在接受了12周的治疗后,分数从1.71分下降到了1.31分,对照组只从1.78分下降到了1.59分。而在安全性上,Olumiant存在着严重感染等潜在风险。综合考虑其疗效和安全性,美国FDA批准了2 mg剂量的Olumiant,且不建议与其他JAK抑制剂或免疫抑制剂共同使用。而作为批准的一部分,研究人员将继续安排临床试验,对Olumiant的长期安全性进行评估。
“为类风湿关节炎患者带来一款新型的有效的治疗方法是一件令人欣慰的事情。TNF抑制剂已不能满足类风湿关节炎患者的需求,这些患者也一般被认为是最难得到治疗的类风湿关节炎患者。”礼来Bio-Medicines的总裁Christi Shaw女士说。
“在临床上,患者频繁出现衰弱症状。他们急需一款适合的新药,”阿拉巴马风湿病护理中心(Rheumatology Care Center)的Elizabeth L. Perkins博士说道:“而Olumiant对风湿病医生来说,是满足患者未竟医疗需求的重要选择。”
礼来计划将于今年第二季度末在美国推出Olumiant。期待这款新药能切实改善类风湿性关节炎成年患者的病情,让他们在没有良药可用的情况下重获希望。
News
相关文章

2023-09-07

2021-10-07

2021-10-08

2021-10-14

2021-10-15
2021-10-19

2021-10-20

2021-10-22
2021-10-22
2021-10-22
Next
下一篇