据5月21日消息,安进制药宣布Prolia(Denosumab)已获美国FDA批准,用于治疗男性和女性因糖皮质激素引起的存在高骨折风险的骨质疏松症(GIOP)。不过需要注意的是,该类患者群过去应曾有过骨质疏松性骨折,存在多个骨折危险因素,其他可用的骨质疏松治疗无效或不耐受。Prolia是首个经批准的特异性靶向RANK配体的生物疗法,RANK配体是骨去除细胞(破骨细胞)的重要调节剂。获得此项批准是由于一项临床3期研究的数据结果积极,相比于接受活性对照药(利塞膦酸盐)患者,接受Prolia治疗的使用糖皮质激素的患者的骨密度(BMD)有更大的提高。
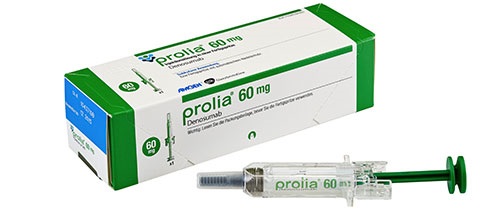
基于临床3期试验12个月的初步分析结果,该试验是一项为期24个月的随机、双盲、双模拟、活性对照研究,评价了Prolia 60 mg每六个月一次皮下注射治疗相较于每日一次口服5mg利塞膦酸钠治疗在795例服用糖皮质激素药物患者中的安全性和有效性。这项研究包括两个患者组:一组为糖皮质激素启动亚组,在入组前接受治疗少于三个月,并计划继续治疗至少六个月;另一组为糖皮质激素持续治疗组,在入组前接受超过或等于三个月的治疗,并计划继续治疗至少六个月。
研究结果表明,在糖皮质激素持续用药亚群中,在一年内Prolia组腰椎骨密度明显高于利塞膦酸盐(分别为3.8%和0.8%),治疗差异为2.9%(p<0.001)。同样,在糖皮质激素启动患者群中,Prolia组的一年后腰椎骨密度明显高于利塞膦酸盐组(分别为4.4%和2.3%),治疗差异为2.2%(p<0.001)。在不同性别、种族、地理区域、绝经状态、基线年龄、腰椎骨密度T-评分及糖皮质激素剂量患者群中均观察到对腰椎骨密度的持续积极影响。
表现出的安全结果与Prolia已知的安全状况一致。最常见的不良反应(大于3%,比活性对照组更常见)是背痛、高血压、支气管炎和头痛。Prolia组有不典型股骨骨折1例。对照组有15例(3.9%),Prolia组有17例(4.3%)报告了严重感染。没有报告颌骨坏死的病例。对照组和Prolia组分别有16例(4.2%)和15例(3.8%)报告了表皮和真皮不良事件(如皮炎、湿疹和皮疹)。
安进制药研发高级副总裁Sean E. Harper博士表示:“作为具有20多年骨质疏松研究经验的骨骼健康领域领导者,很高兴Prolia可用于遭受骨丢失高风险骨折患者的治疗。这种病很严重,因为它会导致骨密度迅速下降,从而提升了骨折风险。Prolia获得批准使得医生和患者多了一种治疗选择。”
临床研究负责人Kenneth F. Saag表示:“长期使用全身性糖皮质激素治疗的患者在开始治疗后的几个月内,骨密度就会显示出明显的下降。随着Prolia批准,接受糖皮质激素治疗的病人又多了一种改善骨密度的选择。”
据悉,Prolia目前已经在全球80多个国家批准和上市。人的躯体靠着骨骼支撑,当骨头出现问题可想而知有多令人烦恼。期待Prolia为越来越多的患者送去快乐的希望,好好享受如画的生活。
News
相关文章

2023-09-07

2021-10-07

2021-10-08

2021-10-14

2021-10-15
2021-10-19

2021-10-20

2021-10-22
2021-10-22
2021-10-22
Next
下一篇