具备临床价值是药物上市需要满足的基本要求。2015 年出台的《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)明确提出,鼓励以临床价值为导向的药物创新。2017年版《药品注册管理办法》(修订稿)也明确提出以药物临床价值为导向的药物审评要求。
因此,创新药物研发和审评应以临床价值为导向,注重物质基础新颖性和原创性的同时关注临床价值的评判。现在比较普遍的药物临床价值定义是指药物满足医疗和临床需求的程度。与现有的医疗措施相比,新药应当可以填补现有临床治疗空白或具有超出现有治疗方法的重大优势。虽然具有明显治疗优势的药物并没有确切的定义,但大致符合以下几个方面:
①具有超出现有水平的重大临床疗效优势,使用后有明显的成果,且不良反应又在可以接受的范围内,药物在临床上往往作为疾病的一线治疗药物,或首选药物。
②虽然之前已经有了相关疾病药物,但与原有的治疗药物相比,新药的不良反应明显减少。
③有的药物是用于治疗对现有治疗方法过敏或无反应的患者,即填补当下治疗空白。
表1 纳入优先审批审评的核心要素汇总

图片来源:新浪医药
对于具有明显临床价值的药物,CFDA已经设立了优先审评审批“路色通道”。2017年12月28日,CFDA官网发布《关于鼓励药品创新实行优先审评审批的意见》,优先审评审批范围如表1所示。从表1我们可以清楚地看到,具有明显临床价值是纳入优先审批审评的核心要素。笔者统计了近两年CFDA公示的优先审评审批名录,遴选出具有明显临床价值的药物,以供各方参考。
从2016年10月28日至2018年3月28日,CFDA发布的共13批优先审评审批名录,共301条受理号,其中98条因具有明显临床价值而被纳入优先审评审批名单,占比约1/3。以药物通用名来计,有11个新药临床试验申请,有40个新药上市申请。
表2 纳入优先审评审批、具有明显临床价值的创新药临床试验申请(2016/10/28-2018/03/28)
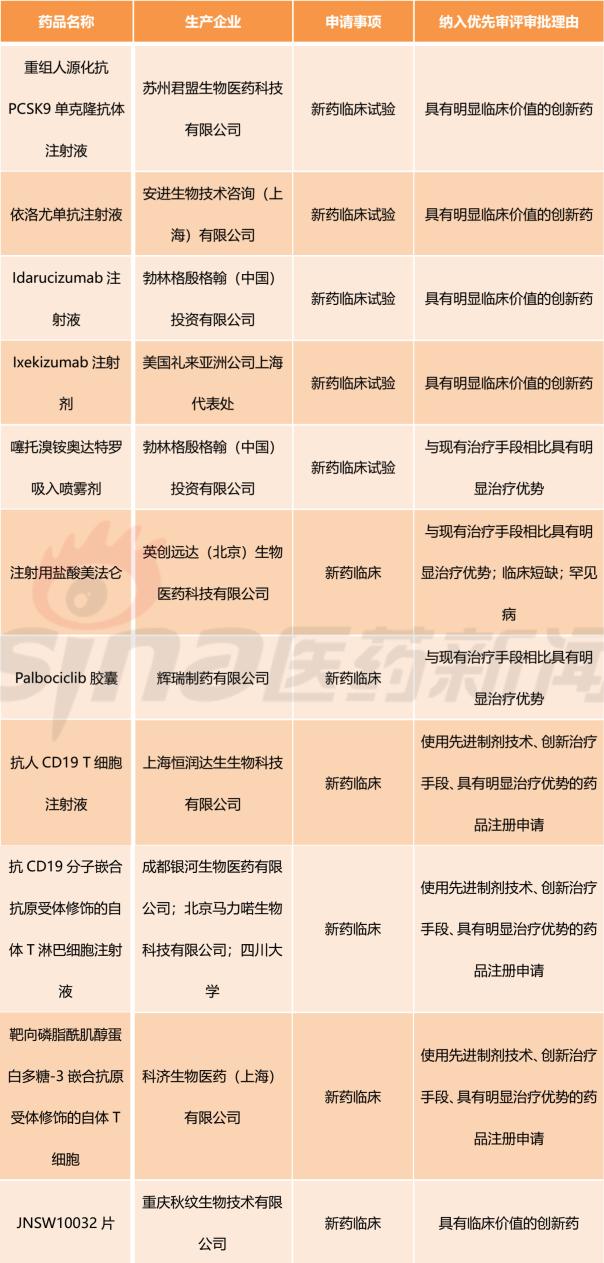
图片来源:新浪医药
新药临床试验申请如表2所示。可以看到,生物药7个,化药4个。生物药里包含单抗和更前沿的T细胞疗法以及CAR-T。比如苏州君盟生物医药科技有限公司研发的重组人源化抗PCSK9单克隆抗体注射液;科济生物医药(上海)有限公司开发的靶向磷脂酰肌醇蛋白多糖-3嵌合抗原受体修饰的自体T细胞。从生产企业来看,既能看到安进、勃林格殷格翰、礼来等国际跨国公司,也包含了英创远达、上海恒润达等很多本土新兴的创新药企业。这表明我国在生物医药创新领域取得了长足的进步。
上述是执行新药临床试验申请的具备明显临床价值的药物,关于执行上市申请的价值药物,我们下篇再谈。
News
相关文章

2023-09-07

2021-10-07

2021-10-08

2021-10-14

2021-10-15
2021-10-19

2021-10-20

2021-10-22
2021-10-22
2021-10-22
Next
下一篇