国际化,似乎是国产PD-1永远的梦,但,这条道路不好走。
► 2022年3月,FDA正式拒批信达生物/礼来的PD-1信迪利单抗在美上市,双方互相退回和收回了相关授权,PD-1出海首次失败;► 2023年5月,EQRx退回基石药业PD-L1抗体、PD-1抗体的相关权益,出海失败;
► 2023年9月,百济神州与诺华共同终止达成的关于替雷利珠单抗的合作,上月欧盟获批上市,FDA正等待后续结果;
功夫不负有心人,首款国产自研PD-1终于叩开了FDA大门,出海成功!
美国时间10月27日,君实生物和Coherus宣布,美国FDA批准君实生物自主研发的PD-1药物特瑞普利单抗注射液(拓益®,美国商品名:LOQTORZITM)两项适应症:与顺铂和吉西他滨联合用于一线治疗成人转移性或复发性局部晚期鼻咽癌,及其单药获批用于复发或转移性鼻咽癌含铂治疗后的二线及以上治疗。这是FDA批准的首个且唯一一款鼻咽癌治疗药物。
受此积极消息影响,当天,Coherus股价在盘后大涨26.14%。Coherus 预计将在2024年2月1日,向君实生物支付2500万美元的里程碑付款。而君实生物也在周一(10月30日)开盘迎来高开,盘中一度涨超14%,截止收盘君实生物报45.72元,涨幅达到5.47%,市值已达到450.7亿。

凭什么君实生物能够做到?
从分析之前国产PD-1出海失败,我们可以窥看一二。信达生物和基石药业折戟的一大原因是临床试验数据来源只有中国,但是,为何君实生物能够豁免美国本土临床数据?
原因之一,君实生物勇闯无人区,在适应症方面另辟蹊径,选择在中国常见的疾病,但在美国属于罕见病的鼻咽癌,按照FDA的指导原则,对罕见病的监管策略将更灵活。
鼻咽癌是一种原发于鼻咽部黏膜上皮的恶性肿瘤,中国的新发病例约占全球的一半,而在美国属于小众市场,在美国,每年新增鼻咽癌0.22万例,其中新增复发/转移性鼻咽癌0.15万例,属于罕见病。并且,重点在于目前美国尚无治疗该类肿瘤的免疫疗法获批,符合美国“未被满足的灵床需求”条件,因此,君实生物使用亚洲人(270例中国大陆、19例中国台湾+新加坡)数据仍被FDA获批上市,之前还获得该适应症的孤儿药资格。
除了适应症的选择之外,疗效数据也是非常亮眼。
此次FDA获批主要基于POLARIS-02研究(NCT02915432)及JUPITER-02研究(NCT03581786)的数据结果,并且分别在《临床肿瘤学杂志》(Journal of Clinical Oncology)和《自然-医学》(Nature Medicine)发表,受到国际认可。
在POLARIS-02临床研究中,特瑞普利单抗在92例既往化疗失败的复发性或转移性鼻咽癌患者中表现出持久的抗肿瘤活性,客观缓解率(ORR)为23.9%,疾病控制率(DCR)为41.3%,中位缓解率OS为15.1个月,安全性可接受。
在JUPITER-02的临床研究中,特瑞普利单抗联合化疗显著改善了无进展生存期(PFS),与单独化疗相比,疾病进展或死亡风险降低48%。特瑞普利单抗还证明了总体生存率(OS)具有统计学意义和临床意义的改善,与单独化疗相比,治疗可使死亡风险降低37%。
君实生物以“小适应证开启快速上市通道”策略的成功,无疑为后续众多创新药闯关FDA打下样板。
随着FDA的批准上市,加上特瑞普利单抗“FDA批准的首个且唯一一款鼻咽癌治疗药物”、“美国国立综合癌症网络(NCCN)推荐PD-1治疗鼻咽癌”两个BUFF加持,Coherus对PD-1未来的销售预期充满信心,预计2~3年达到最大化的市场渗透率,销售峰值将达到2亿美金。
► 商业化生产方面,君实生物已自建了符合国际标准的大分子生产厂,并配备一套成熟和完善的CGMP质量管理体系和高素质的人才队伍;► 商业推广方面,电话会议中,Coherus表示,8-12周时间就能完成产品进入销售的准备工作,此外,Coherus拥有强大的肿瘤药物销售渠道,特瑞普利单抗与自身产品线有95%的重叠,拥有更成熟的销售经验,并且不会大幅提高销售费用;
► 商务合作方面,有了美国FDA对产品质量的肯定,便是打开了全球的市场,有更多的海外企业愿意合作,随着单药、联合疗法、新适应症的获批,特瑞普利单抗未来可期。

君实生物PD-1的布局
特瑞普利单抗作为我国首个国产批准上市PD-1药物,出海美国只是敲门砖,全球化才是最终目的。
2022年12月和2023年2月,欧洲药品管理局(EMA)和英国药品和保健品管理局(MHRA)分别受理了特瑞普利单抗联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗以及联合紫杉醇和顺铂用于不可切除局部晚期/复发或转移性食管鳞癌患者的一线治疗的上市许可申请(MAA)。
君实生物就特瑞普利单抗与Dr. Reddy’s、Hikma、康联达等海外合作伙伴在超过50个国家达成商业化合作,覆盖中东、北非、东南亚等地区。
截至目前,特瑞普利单抗至今已在全球(包括中国、美国、东南亚及欧洲等地)开展了覆盖超过15个适应症的30多项由君实生物发起的临床研究。肿瘤适应症包括:肺癌、鼻咽癌、食管癌、胃癌、膀胱癌、乳腺癌、肝癌、肾癌及皮肤癌等。并且,在国际化布局方面,特瑞普利单抗已在黏膜黑色素瘤、鼻咽癌、软组织肉瘤、食管癌、小细胞肺癌领域获得FDA授予2项突破性疗法认定、1项快速通道认定、1项优先审评认定和5项孤儿药资格认定。
在中国,特瑞普利单抗已获批了6项适应症,有3项适应症被纳入《2022年药品目录》,是国家医保目录中唯一用于治疗黑色素瘤的抗PD-1药物:
2018年12月,用于既往接受全身系统治疗失败的不可切除或转移性黑色素瘤的治疗;
2021年2月,用于既往接受过二线及以上系统治疗失败的复发/转移性鼻咽癌患者的治疗;
2021年4月,用于含铂化疗失败包括新辅助或辅助化疗12个月内进展的局部晚期或转移性尿路上皮癌的治疗;
2021年11月,联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗;
2022年5月,联合紫杉醇和顺铂用于不可切除局部晚期/复发或远处转移性食管鳞癌患者的一线治疗;
2022年9月,联合培美曲塞和铂类用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、不可手术切除的局部晚期或转移性非鳞状非小细胞肺癌的一线治疗;
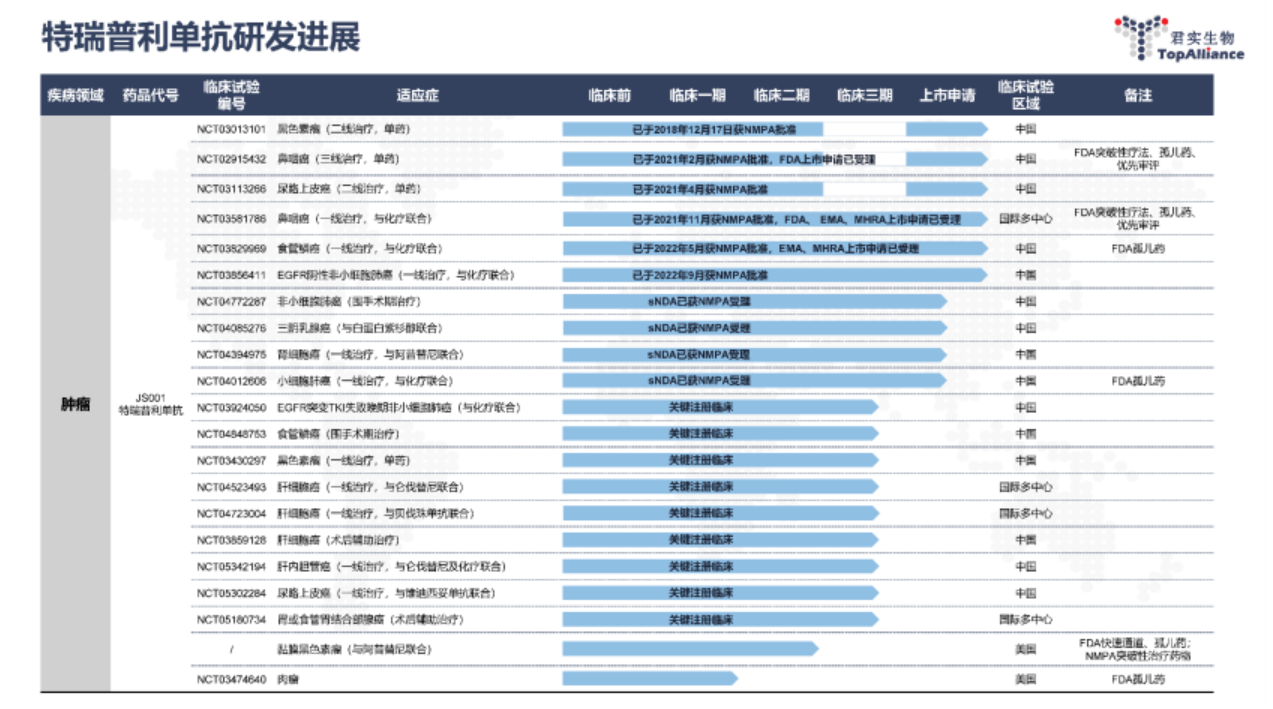
图源:君实生物2023H1财报
News
相关文章

2023-08-09

2021-09-28
2021-09-28
2021-10-01

2021-10-07

2023-09-07
2021-10-07

2021-10-08

2021-10-09

2021-10-09
Next
下一篇